陽明交大結構生物學團隊 助解決癌細胞抗藥性

↑圖/陽明交大提供
國立
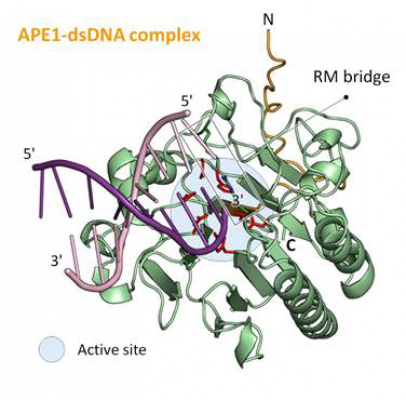
陽明交通大學生物科技學院結構生物學團隊利用X-ray蛋白質晶體學方法,解析APE1蛋白質與DNA的複合物結構,了解人體中APE1蛋白質的活性如何被癌細胞利用,藉此修復因藥物而受損之癌細胞DNA,進而對DNA破壞類型的抗癌藥物產生抗藥性,未來若能夠利用結構基礎藥物設計(Structure-based drug design)來阻斷APE1的活性,將可解決部分癌細胞的抗藥性問題。
這項耗時三年完成的研究工作由生科院分醫所蕭育源副教授主導、實驗由博士生劉東璋、碩士生林俊廷、郭鎧瑋與大學專題生張楷成共同執行,與生資所朱智瑋教授共同合作。這個由陽明交通大學生物科技學院獨立完成的突破性成果已發表於國際頂尖期刊《自然通訊》(Nature Communications),獲高度關注。此論文可至此網址下載:https://www.nature.com/articles/s41467-020-20853-2。
↑圖/陽明交大提供
APE1蛋白質具有氧化還原、DNA內部剪切及DNA外側剪切能力,分別與癌細胞的增生以及抗藥性相關。部分抗癌藥物可藉由損壞癌細胞的DNA或直接嵌入癌細胞的DNA中阻斷癌細胞DNA複製來殺死癌細胞;而癌細胞亦可能利用APE1的DNA修復能力以及外側剪切活性來修補癌細胞的DNA或移除嵌入DNA中的抗癌藥物而使得部分抗癌藥物失效。然而APE1蛋白質的DNA外側剪切活性的作用機轉並未明瞭,也因此陽明交大結構生物學研究團隊利用X-ray蛋白質晶體學方法,解析出數種APE1-DNA複合體結構,輔以酵素活性分析,系統性的建構出APE1的DNA外側剪切活性分子機制,確實了解APE1蛋白質如何對DNA進行剪切。未來可依據這些APE1的蛋白質結構開發小分子抑制劑,對抗癌細胞的抗藥性問題。
這項研究工作經費與設施由科技部年輕學者養成計畫-哥倫布計畫、陽明交通大學生物科技學院、智慧型藥物與智能生物裝置研究中心、智能動態系統生物中心、高雄醫學大學新藥開發暨價創研究中心和國家同步輻射中心共同支持。蕭育源副教授表示除了年輕學者養成計畫為主要經費支持之外,由陽明交通大學的生物科技學院所提供的硬體,如新落成的生醫大樓賢齊館,以及陽明交通大學兩個研究中心所提供的研究鍵結與儀器設施更是促成此研究成果的主要推手,相信合校後的陽明交通大學一定會有更良好的研究產出。

↑圖/陽明交大提供